1 University Institute for Research on Agricultural Resources (INURA), University of Extremadura, Avda. de la Investigación s/n, Campus Universitario, 06006 Badajoz, Spain
2 Institute of Food Science, Technology and Nutrition, Spanish National Research Council (ICTAN-CSIC), C/ José Antonio Novais, 10, 28040 Madrid, Spain
3. Cherry Times technical-scientific committee

La qualità commerciale della ciliegia dolce (Prunus avium L.) dipende in modo cruciale dall’integrità della buccia; di conseguenza, la suscettibilità al cracking indotto dall’acqua rappresenta tuttora uno dei principali vincoli economici per la produzione (Gutiérrez et al., 2021; Brüggenwirth & Knoche, 2016).
All’interno di questo insieme di alterazioni epidermiche, la macchia acquosa è stata recentemente descritta come una problematica emergente sia in pre- sia in post-raccolta nella ciliegia dolce: i sintomi possono iniziare già sulla pianta, ma la loro espressione tende ad accentuarsi durante la conservazione a freddo, compromettendo la commerciabilità, in particolare nelle varietà precoci come ‘Burlat’ (Serradilla et al., 2021).
Il fenotipo esterno caratteristico è costituito da aree depresse con un aspetto traslucido e impregnato d’acqua e, frequentemente, da decolorazioni di tipo metallico, generalmente concentrate sulle “spalle” del frutto e attorno al punto di inserzione del peduncolo (Fig. 1).In Spagna, le Condizioni Speciali dell’Assicurazione per il Frutteto di Ciliegio (Linea 317, Piano 2025) inquadrano questo tipo di danno epidermico nell’ambito della copertura per il rischio pioggia e lo definiscono come “decolorazioni di tipo metallico e/o riassorbimenti che provocano il degrado dell’epidermide del frutto in conseguenza della persistenza di acqua sul frutto durante la maturazione, determinando una perdita di valore commerciale” (Fig. 1).
 Figura 1. Sintomi esterni rappresentativi della macchia acquosa nella ciliegia dolce ‘Burlat’.
Figura 1. Sintomi esterni rappresentativi della macchia acquosa nella ciliegia dolce ‘Burlat’.
Dal punto di vista fisiopatologico, le evidenze disponibili in letteratura supportano uno scenario in cui una predisposizione strutturale e fisiologica dell’esocarpo può favorire una successiva evoluzione del fenomeno associata alla colonizzazione microbica.
Nella fase iniziale, il processo è legato al cedimento meccanico della barriera protettiva del frutto, aggravato da sequenze agroclimatiche caratterizzate da precipitazioni seguite da aumenti di temperatura, che favoriscono una prolungata permanenza di acqua liquida sulla superficie del frutto (Serradilla et al., 2021).
Durante la fase III di crescita del frutto, l’esocarpo è sottoposto a un’elevata deformazione elastica: il frutto continua ad aumentare rapidamente di volume mentre la deposizione di nuova membrana cuticolare (CM) è limitata, con il risultato che la cuticola opera in prossimità della propria soglia meccanica (Knoche et al., 2004; Peschel & Knoche, 2012).
Questa vulnerabilità è stata descritta in dettaglio per la cultivar ‘Burlat’, le cui caratteristiche meccaniche e strutturali la collocano nella fascia più bassa dell’intervallo di resistenza riportato per la buccia della ciliegia dolce.
In particolare, ‘Burlat’ presenta valori ridotti del modulo di elasticità (E) e della pressione di frattura (P_frattura), indicativi di una limitata resistenza all’estensione della buccia (Brüggenwirth & Knoche, 2016).
La cultivar mostra inoltre tra i più bassi valori di massa di membrana cuticolare per unità di superficie (≈0,95 g·m⁻²) e di carico di cere epicuticolari (≈0,21 g·m⁻²) tra le cultivar valutate (Peschel & Knoche, 2012).
Di conseguenza, i frutti di ‘Burlat’ richiedono mediamente solo circa un terzo dell’assorbimento idrico necessario a una cultivar più tollerante per raggiungere la frattura della buccia (WU₅₀ ≈ 50,5 mg; Brüggenwirth & Knoche, 2016).
Questa ridotta robustezza è stata inoltre associata a una minore massa secca della parete cellulare per unità di peso fresco rispetto a cultivar meno suscettibili (Brüggenwirth & Knoche, 2016).
La combinazione di una cuticola relativamente leggera, di una bassa rigidità e di pareti cellulari comparativamente più deboli fa sì che l’esposizione ad acqua liquida o ad atmosfere ad elevata umidità riduca in modo significativo la resistenza alla frattura della membrana cuticolare (CM) (Knoche & Peschel, 2006; Winkler et al., 2020a).
In tali condizioni possono svilupparsi microfessurazioni della cuticola, considerate il più precoce segnale rilevabile di cedimento dell’esocarpo (Peschel & Knoche, 2005; Knoche & Peschel, 2006).
Questi difetti compromettono la funzione barriera della buccia (Knoche & Peschel, 2006) e creano vie ad alta conducibilità per il flusso di acqua verso i tessuti sottostanti (Weichert & Knoche, 2006).
Integrando tali evidenze, è possibile proporre un modello meccanicistico secondo il quale un afflusso idrico localizzato innalza il turgore oltre la capacità meccanica del parenchima esterno (Quero-García et al., 2021), determinando il collasso di gruppi cellulari alla periferia del frutto (Grimm et al., 2019; Winkler et al., 2020b).
Questo collasso è accompagnato dal rilascio nell’apoplasto di soluti osmoticamente attivi, inclusi zuccheri, sorbitolo e antociani (Winkler et al., 2020b), generando una matrice caratterizzata da perdita di integrità strutturale e da una maggiore disponibilità di substrati.
Come conseguenza della perdita di integrità strutturale dell’esocarpo e del parenchima esterno, e in un contesto tissutale con aumentata disponibilità di substrati, l’espressione clinica della macchia acquosa si manifesta esternamente come aree depresse, traslucide e dall’aspetto impregnato d’acqua, spesso accompagnate da un progressivo ammorbidimento del tessuto (Fig. 1).
In questo contesto è stato descritto uno scenario di consorzio microbico, nel quale Botrytis cinerea è stata rilevata nelle fasi iniziali all’interno del mesocarpo e, con il progredire del deterioramento, è stata osservata la co-occorrenza di batteri appartenenti all’ordine Enterobacterales.
Questa componente microbica è stata associata all’evoluzione verso un’estesa disgregazione cellulare e alla macerazione enzimatica dei tessuti e, negli stadi avanzati, alla comparsa di micelio visibile in superficie (Serradilla et al., 2021).
L’obiettivo di questo studio è fornire approfondimenti fisiopatologici sulla macchia acquosa nella ciliegia dolce ‘Burlat’ attraverso una caratterizzazione integrata dei frutti colpiti.
A tal fine, frutti privi di lesioni visibili e frutti affetti da macchia acquosa sono stati confrontati a uno stadio di maturazione commerciale equivalente, combinando evidenze complementari relative all’espressione del danno a livello tissutale (struttura e microstruttura), alle modifiche compositive (profilo fenolico), agli effetti sulla qualità fisico-chimica (colore, consistenza, solidi solubili, acidità titolabile e calibro) e alla risposta fisiologica associata (respirazione e produzione di etilene).
Su questa base, è stata inoltre valutata l’espressione del fenomeno nel segnale ottico lungo le bande del visibile e del vicino infrarosso (NIR), come primo passo verso una diagnosi non distruttiva e come premessa a successive analisi iperspettrali.
Un aspetto centrale nell’interpretazione della macchia acquosa in ‘Burlat’ consiste nello stabilire se il disordine sia confinato all’epidermide oppure coinvolga il collasso dei tessuti subepidermici.
Il sezionamento dei frutti e l’analisi istologica comparativa consentono di localizzare in modo inequivocabile il danno nel mesocarpo esterno e di definirne con precisione la profondità effettiva (Fig. 2; Fig. 3).
A livello macroscopico, il sezionamento parziale dei frutti colpiti evidenzia che, al di sotto dell’area esterna dall’aspetto impregnato d’acqua, è presente una banda continua di imbrunimento subepidermico, nettamente delimitata rispetto ai tessuti più interni (Fig. 2).
Questa zona scurita è localizzata nel mesocarpo esterno e definisce una lesione localizzata ma strutturalmente rilevante, piuttosto che una semplice alterazione cromatica superficiale.
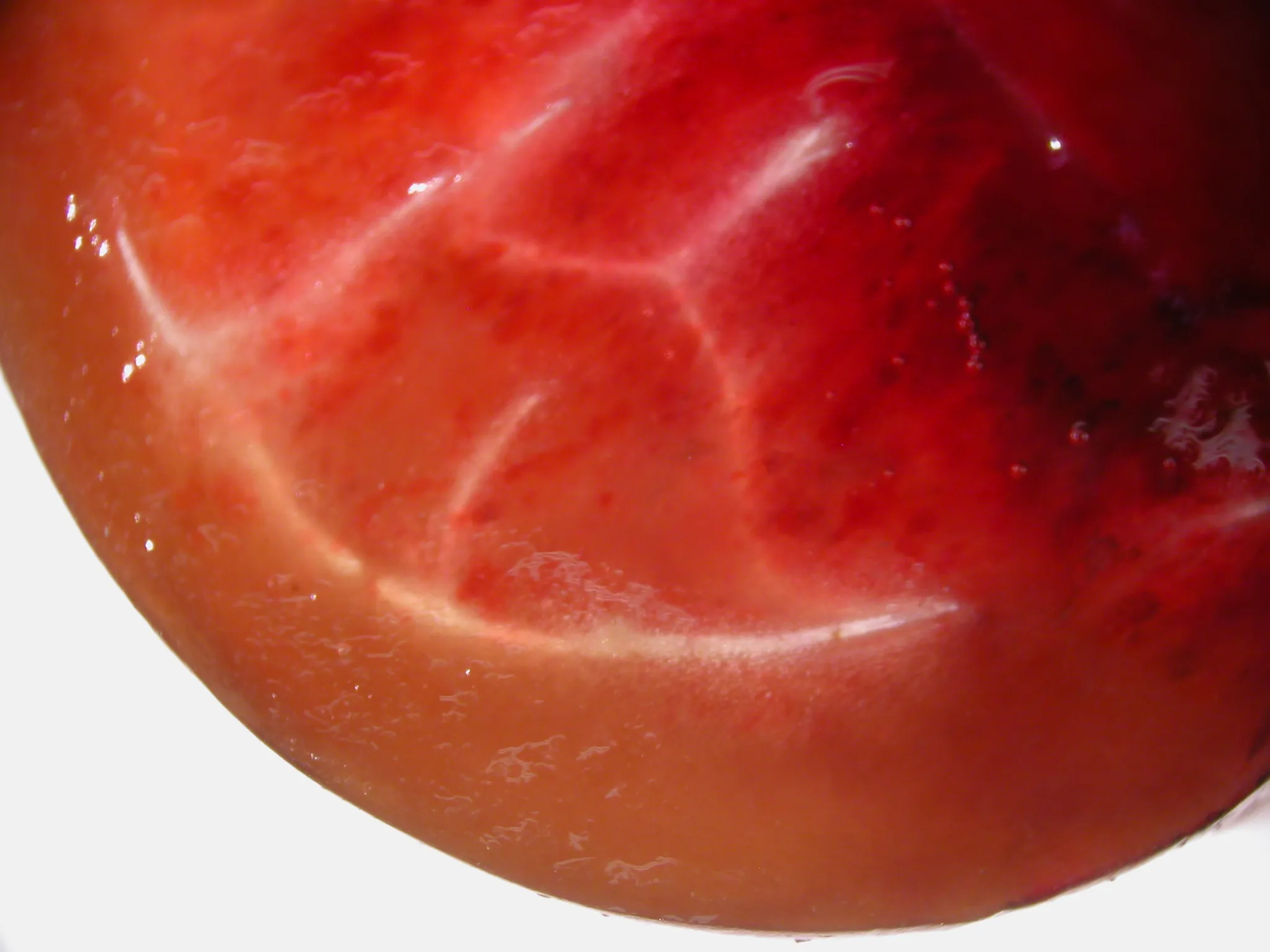 Figura 2. Sezione parziale della regione della “spalla” di un frutto di ciliegia dolce ‘Burlat’ affetto da macchia acquosa, osservata al microscopio stereoscopico, che evidenzia una banda di imbrunimento subepidermico nel mesocarpo esterno.
Figura 2. Sezione parziale della regione della “spalla” di un frutto di ciliegia dolce ‘Burlat’ affetto da macchia acquosa, osservata al microscopio stereoscopico, che evidenzia una banda di imbrunimento subepidermico nel mesocarpo esterno.
L’istologia comparativa conferma questo quadro (Fig. 3). Nei frutti sani, l’epidermide forma uno strato regolare rivestito da una cuticola continua, mentre il parenchima subepidermico è costituito prevalentemente da cellule isodiametriche con pareti ben definite e da un’organizzazione tissutale compatta.
Nei frutti colpiti, il mesocarpo esterno mostra una marcata disorganizzazione, con cellule deformate o collassate, aumento degli spazi intercellulari e perdita dell’architettura compatta osservata nel controllo.
All’interfaccia epidermide–cuticola si osservano ondulazioni e distacchi parziali localizzati tra la cuticola e la parete cellulare sottostante, un quadro coerente con la presenza di discontinuità in grado di facilitare l’ingresso localizzato di acqua (Fig. 3).
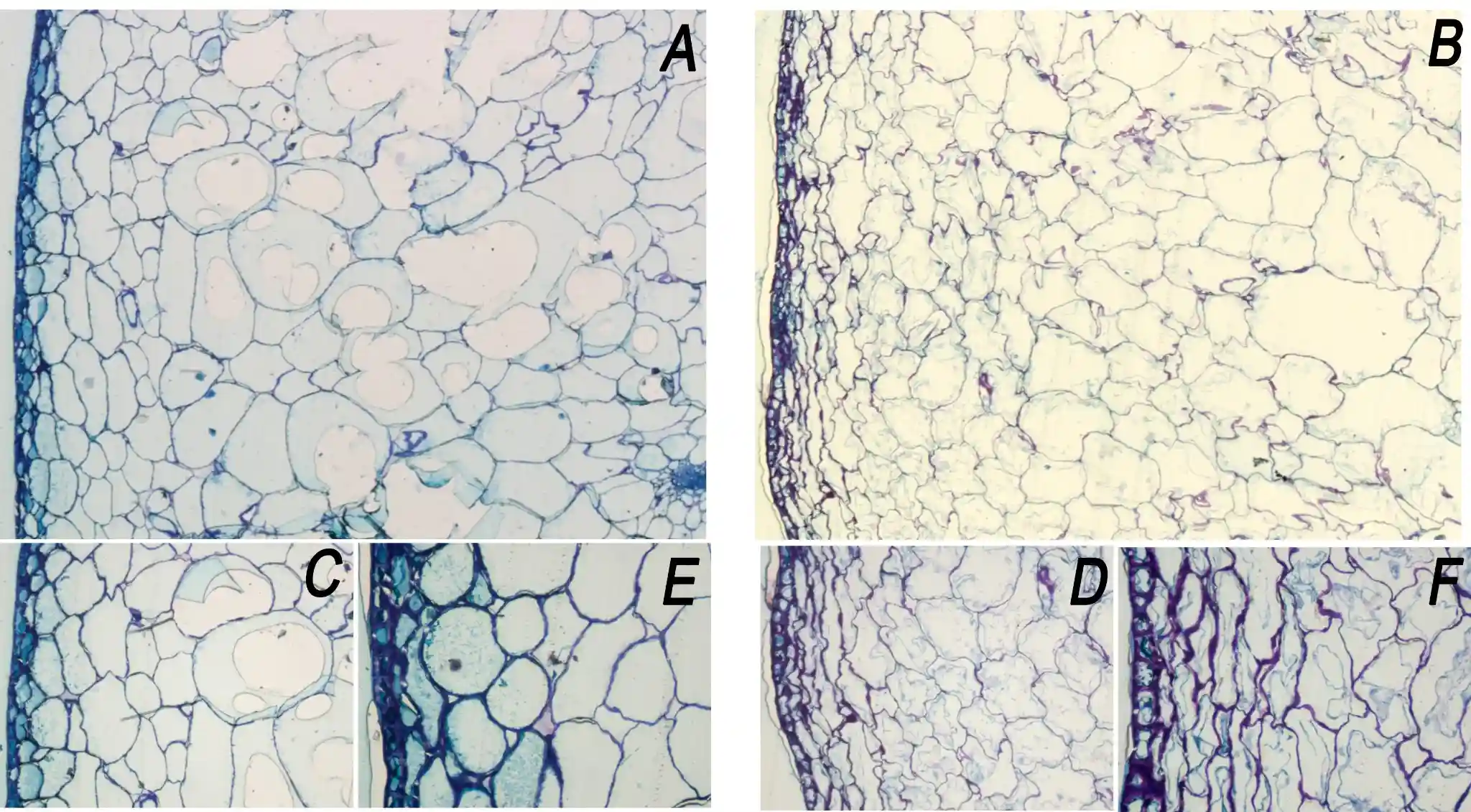 Figura 3. Sezioni istologiche trasversali di ciliegia dolce ‘Burlat’ sana (A, C, E) e di frutti affetti da macchia acquosa (B, D, F). (A–B) Vista d’insieme del mesocarpo esterno (4×). (C–D) Dettaglio del parenchima subepidermico (10×). (E–F) Dettaglio dell’epidermide e dell’interfaccia epidermide–cuticola (20×).
Figura 3. Sezioni istologiche trasversali di ciliegia dolce ‘Burlat’ sana (A, C, E) e di frutti affetti da macchia acquosa (B, D, F). (A–B) Vista d’insieme del mesocarpo esterno (4×). (C–D) Dettaglio del parenchima subepidermico (10×). (E–F) Dettaglio dell’epidermide e dell’interfaccia epidermide–cuticola (20×).
Nel loro insieme, queste osservazioni strutturali e microstrutturali indicano che la macchia acquosa in ‘Burlat’ debba essere considerata una fisiopatia epidermico–subepidermica, associata al collasso del mesocarpo esterno e ad alterazioni della continuità cuticolare.
Questa architettura danneggiata può costituire un substrato predisponente alla successiva progressione del deterioramento in condizioni favorevoli, inclusa la colonizzazione microbica descritta per questo disordine.
Oltre alle evidenze strutturali e microstrutturali, è stato valutato l’impatto della macchia acquosa sulla composizione fenolica della buccia di ‘Burlat’.
Gli estratti di buccia ottenuti da frutti visivamente sani sono stati confrontati con estratti prelevati esclusivamente dall’area lesionata di frutti affetti, selezionando entrambi i gruppi a uno stadio di maturazione commerciale equivalente.
I singoli composti sono stati quantificati mediante cromatografia liquida ad alte prestazioni con rivelazione a diodo (HPLC–DAD) e i risultati sono espressi come mg per 100 g di peso fresco (FW) di buccia (Tabella 1).
Considerando l’insieme dei composti analizzati, la buccia lesionata ha mostrato una marcata deplezione di fenoli rispetto alla buccia sana (Tabella 1).
Le riduzioni relative più elevate sono state osservate per gli antociani principali (cianidina-3-glucoside e cianidina-3-rutinoside), con concentrazioni nel tessuto lesionato ridotte a una piccola frazione di quelle misurate nella buccia sana.
Un andamento analogo è stato riscontrato per i flavan-3-oli e le procianidine—(+)-catechina, (−)-epicatechina e i loro oligomeri—che hanno anch’essi evidenziato forti diminuzioni (Tabella 1).
Anche gli acidi idrossicinnamici (isomeri caffeilchinici e cumaroilchinici, nonché l’acido feruloilchinico) e gli acidi idrossibenzoici risultano sostanzialmente ridotti nella buccia lesionata, mentre i flavonoli (rutina e glicosidi della quercetina e del kaempferolo) mostrano diminuzioni meno estreme, ma comunque pronunciate (Tabella 1).
Nel complesso, la macchia acquosa è associata a una forte riduzione del pool fenolico nel tessuto epidermico interessato.
A livello macroscopico, questo cambiamento compositivo coincide con un’evidente perdita di pigmentazione e con il caratteristico aspetto traslucido e impregnato d’acqua della lesione (Fig. 4), in linea con la marcata deplezione di antociani e di altri composti fenolici correlati quantificata nella buccia lesionata.
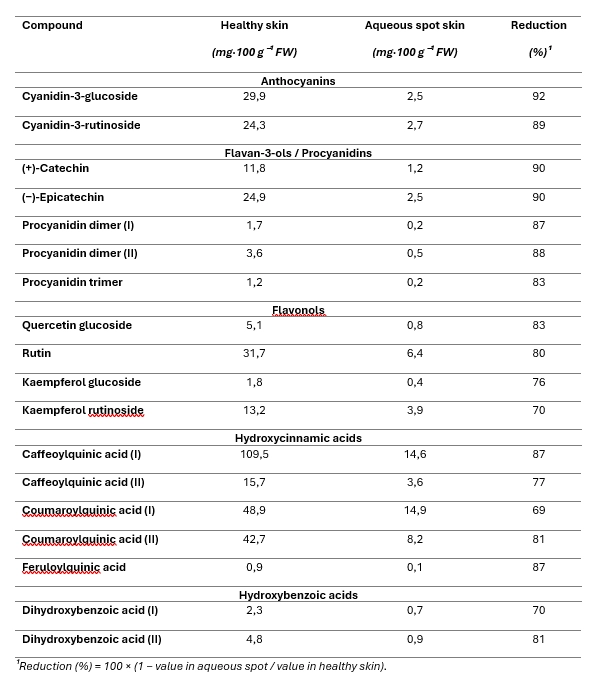 Tabella 1. Concentrazione dei singoli polifenoli nella buccia di ciliegia dolce ‘Burlat’ (mg·100 g⁻¹ di peso fresco, FW), a confronto tra frutti sani e buccia campionata dall’area lesionata di frutti affetti da macchia acquosa.
Tabella 1. Concentrazione dei singoli polifenoli nella buccia di ciliegia dolce ‘Burlat’ (mg·100 g⁻¹ di peso fresco, FW), a confronto tra frutti sani e buccia campionata dall’area lesionata di frutti affetti da macchia acquosa.
 Figura 4. Confronto macroscopico tra un frutto di ciliegia dolce ‘Burlat’ affetto da macchia acquosa (a sinistra) e un frutto sano (a destra), dopo il sollevamento di un segmento di buccia dalla regione della “spalla”.
Figura 4. Confronto macroscopico tra un frutto di ciliegia dolce ‘Burlat’ affetto da macchia acquosa (a sinistra) e un frutto sano (a destra), dopo il sollevamento di un segmento di buccia dalla regione della “spalla”.
Il confronto tra frutti di ‘Burlat’ sani e frutti affetti da macchia acquosa indica un effetto marcato sulla consistenza, mentre i classici indici di maturazione interna risultano solo minimamente influenzati (Tabella 2).
Dal punto di vista meccanico, la consistenza misurata con penetrometro Durofel è chiaramente inferiore nei frutti colpiti, con una riduzione di circa il 15% rispetto ai frutti sani e differenze altamente significative (p < 0,0001).
Questa perdita di resistenza alla deformazione è coerente con il collasso del mesocarpo esterno osservato nelle sezioni istologiche e conferma che il disordine compromette in modo sostanziale l’integrità strutturale degli strati subepidermici.
Al contrario, il contenuto di solidi solubili (SSC) e l’acidità titolabile mostrano valori molto simili nei frutti sani e in quelli affetti, senza differenze significative.
Le distribuzioni di entrambi i parametri si sovrappongono ampiamente, indicando che la macchia acquosa non altera in maniera apprezzabile la maturazione zuccherina né l’equilibrio di base degli acidi organici al momento della raccolta.
Nel complesso, questi risultati collocano il segnale più coerente della macchia acquosa a livello strutturale, ossia nella perdita di consistenza, piuttosto che in una variazione dei parametri di maturazione interna considerati.
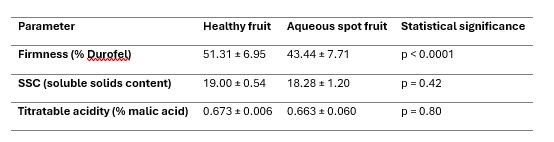 Tabella 2. Parametri di qualità in frutti di ciliegia dolce ‘Burlat’ sani e affetti da macchia acquosa (media ± deviazione standard).
Tabella 2. Parametri di qualità in frutti di ciliegia dolce ‘Burlat’ sani e affetti da macchia acquosa (media ± deviazione standard).
La valutazione fisiologica si è concentrata su due variabili chiave: il tasso di respirazione e la produzione di etilene in frutti di ciliegia dolce ‘Burlat’ sani e affetti da macchia acquosa, condizionati a 20 °C in condizioni controllate.
Per quanto riguarda la respirazione, i frutti affetti da macchia acquosa hanno mostrato un lieve incremento rispetto al gruppo di controllo (98,94 vs 91,63 mg CO₂ kg⁻¹ h⁻¹, rispettivamente).
Tuttavia, la variabilità all’interno dei gruppi è risultata elevata e il confronto statistico non ha evidenziato differenze significative tra i due gruppi (p = 0,57).
Questi risultati indicano che la presenza di lesioni visibili non si traduce necessariamente in un’accelerazione uniforme del metabolismo respiratorio in tutti i frutti colpiti, ma piuttosto in risposte eterogenee all’interno del lotto interessato.
Al contrario, la produzione di etilene ha risposto in modo evidente alla presenza della macchia acquosa.
Le ciliegie affette hanno mostrato un tasso medio di produzione pari a 57,21 µg C₂H₄ kg⁻¹ h⁻¹, rispetto ai 47,43 µg C₂H₄ kg⁻¹ h⁻¹ del gruppo di controllo, corrispondente a un incremento di circa il 20%.
Questa differenza è risultata statisticamente significativa (p < 0,05) ed è stata accompagnata da un insieme di valori più elevato e più concentrato nel gruppo dei frutti colpiti (Fig. 5), in linea con l’attivazione di vie metaboliche associate a stress e/o senescenza nei frutti che presentano lesioni visibili.
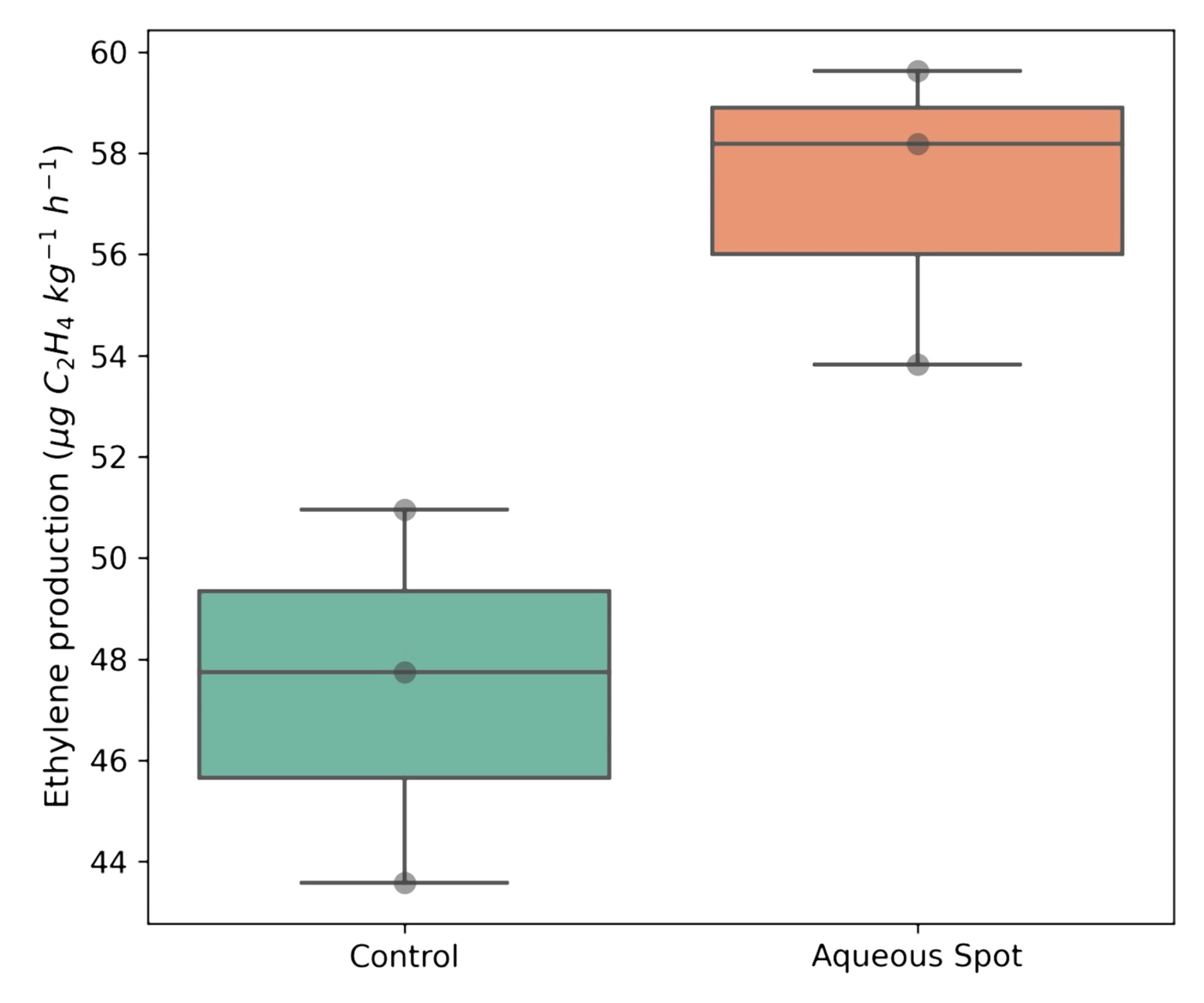 Figura 5. Produzione di etilene in ciliegie dolci ‘Burlat’ sane (Controllo) e affette da macchia acquosa dopo 24 h di condizionamento a 20 °C. I boxplot mostrano la distribuzione dei valori sperimentali.
Figura 5. Produzione di etilene in ciliegie dolci ‘Burlat’ sane (Controllo) e affette da macchia acquosa dopo 24 h di condizionamento a 20 °C. I boxplot mostrano la distribuzione dei valori sperimentali.
Come fase preliminare all’analisi spettrale nel visibile–NIR, è stato caratterizzato il colore superficiale del frutto in tre categorie tissutali di ‘Burlat’: frutti di controllo privi di sintomi, tessuto visivamente sano su frutti che presentano macchia acquosa e tessuto lesionato all’interno dell’area colpita (Fig. 6).
Il colore è stato quantificato nello spazio CIE LCh° mediante spettrofotometria in riflettanza, in condizioni strumentali standardizzate.
Nei frutti di controllo, i valori di L*, C* e h° rientravano nell’intervallo atteso per ‘Burlat’ allo stadio di maturazione commerciale.
Anche il tessuto visivamente sano sui frutti affetti da macchia acquosa ha mostrato un profilo comparabile, a supporto dell’ipotesi che il disordine non si manifesti in modo uniforme sull’intera epidermide, ma rimanga confinato a regioni discrete della superficie del frutto (Fig. 6).
Al contrario, il tessuto lesionato ha evidenziato uno spostamento coerente delle coordinate cromatiche rispetto alle altre due condizioni (Fig. 6).
L’aumento di L* è compatibile con l’aspetto più chiaro e traslucido dell’area colpita; C* tende a diminuire, mentre h° si sposta verso valori più elevati, indicando una variazione di tonalità associata a una riduzione dell’intensità del colore rosso.
Questo andamento è coerente con la depigmentazione osservata a livello macroscopico e con le modificazioni compositive dei fenoli documentate in precedenza.
Nel complesso, la colorimetria CIE LCh° definisce una firma superficiale distinta per il tessuto lesionato rispetto sia ai frutti di controllo sia al tessuto visivamente sano presente sullo stesso frutto (Fig. 6).
Su queste basi, il passo successivo è stato verificare se tale segnale ottico sia espresso in modo concordante nella risposta spettrale nel visibile–NIR, come primo approccio a una diagnosi non distruttiva e come premessa a successive analisi iperspettrali.
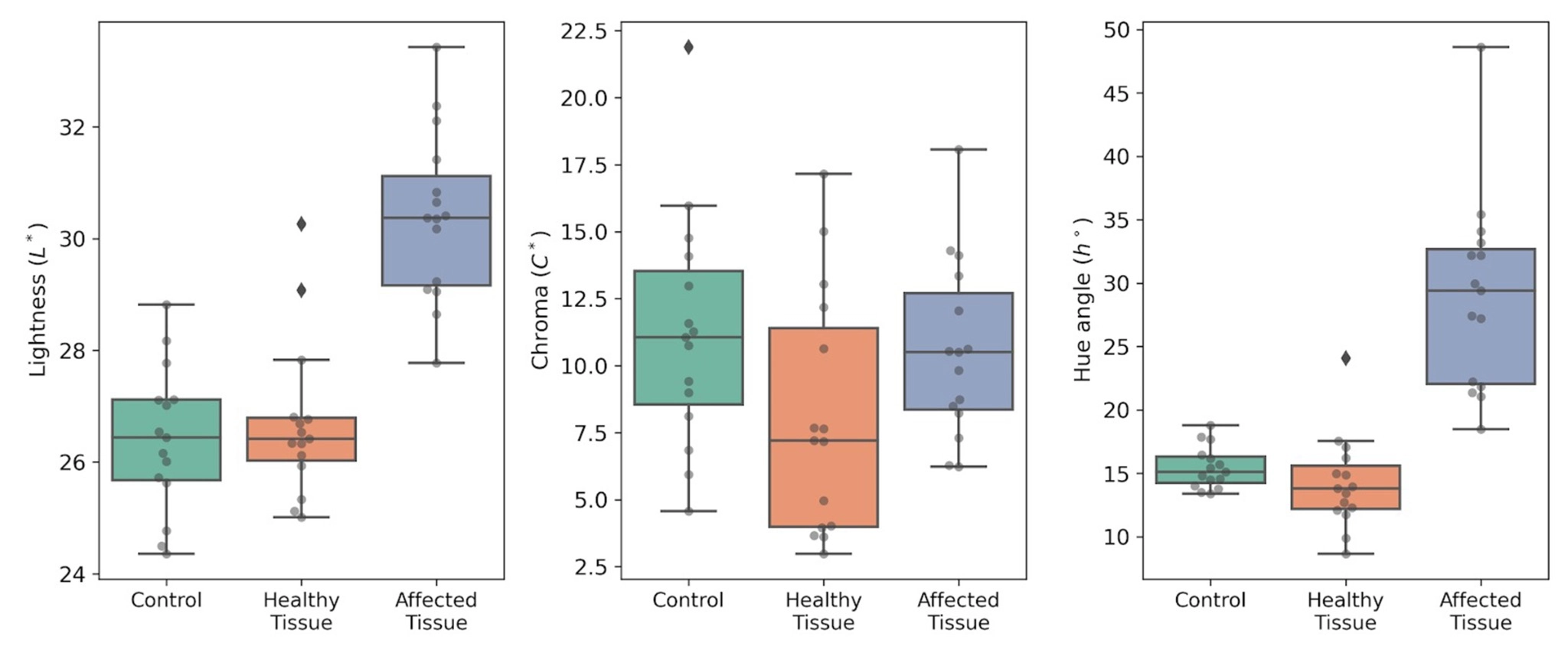 Figura 6. Parametri cromatici CIE LCh° nella ciliegia dolce ‘Burlat’: frutti di controllo (Control), tessuto visivamente sano su frutti con macchia acquosa (Healthy tissue) e tessuto lesionato (Affected tissue). Sinistra: L*; centro: C*; destra: h°. Le misure sono state effettuate con uno spettrofotometro CM-3500d (Konica Minolta), illuminante D65 e osservatore a 10°.
Figura 6. Parametri cromatici CIE LCh° nella ciliegia dolce ‘Burlat’: frutti di controllo (Control), tessuto visivamente sano su frutti con macchia acquosa (Healthy tissue) e tessuto lesionato (Affected tissue). Sinistra: L*; centro: C*; destra: h°. Le misure sono state effettuate con uno spettrofotometro CM-3500d (Konica Minolta), illuminante D65 e osservatore a 10°.
La spettroscopia di riflettanza nel visibile fornisce una descrizione continua dell’interazione tra radiazione e tessuto e consente quindi di rilevare variazioni guidate sia dall’assorbimento dei pigmenti sia dalla diffusione della luce dipendente dalla microstruttura.
In ‘Burlat’, le curve medie di riflettanza mostrano una separazione coerente tra i frutti di controllo e quelli affetti da macchia acquosa (Fig. 7): le differenze risultano modeste alle lunghezze d’onda più corte, ma diventano progressivamente più evidenti con l’aumentare della lunghezza d’onda.
Il tessuto colpito presenta un profilo distinto nella regione del verde–giallo e, soprattutto, un comportamento differenziale nella transizione tra rosso e red-edge.
In quest’area, lo spettro del tessuto lesionato evidenzia una pendenza modificata e una risposta attenuata rispetto al controllo, un andamento coerente con una ridotta capacità di assorbimento effettivo associata alla pigmentazione rossa e con modificazioni concomitanti della componente di diffusione del tessuto.
Questo comportamento è in linea con le alterazioni subepidermiche descritte in precedenza.
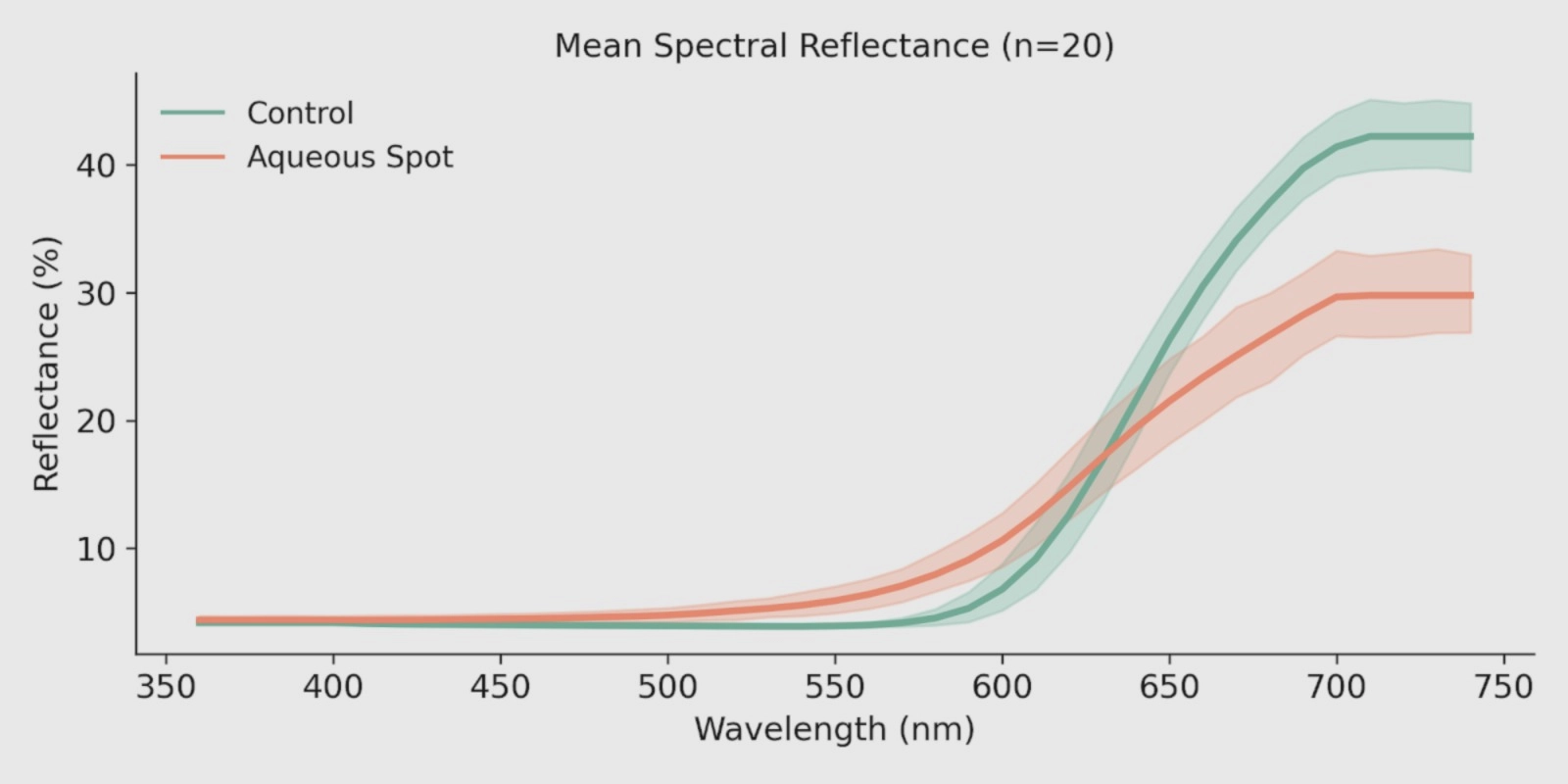 Figura 7. Spettri medi di riflettanza nel visibile (360–740 nm) in ciliegie dolci ‘Burlat’ di controllo e affette da macchia acquosa (n = 10). Le misure sono state effettuate con uno spettrofotometro CM-3500d (Konica Minolta), illuminante D65 e osservatore a 10°. Le bande ombreggiate indicano la variabilità delle misurazioni.
Figura 7. Spettri medi di riflettanza nel visibile (360–740 nm) in ciliegie dolci ‘Burlat’ di controllo e affette da macchia acquosa (n = 10). Le misure sono state effettuate con uno spettrofotometro CM-3500d (Konica Minolta), illuminante D65 e osservatore a 10°. Le bande ombreggiate indicano la variabilità delle misurazioni.
Per quantificare gli spostamenti osservati nelle curve di riflettanza, sono stati calcolati (i) la prima derivata della riflettanza nella regione del red-edge e (ii) un indice di riflettanza correlato agli antociani (ARI), utilizzando le stesse misurazioni (Fig. 8).
Nei profili della prima derivata (Fig. 8, a sinistra), il massimo caratteristico del red-edge risulta nettamente più pronunciato nei frutti di controllo, mentre nei frutti affetti da macchia acquosa si osserva un’attenuazione di questo gradiente spettrale.
Tale comportamento è coerente con un’interazione luce–tessuto alterata nell’area lesionata, in accordo con le differenze descritte nel profilo di riflettanza nel visibile.
I valori di ARI (Fig. 8, a destra) discriminano i due gruppi, mostrando valori più bassi e una maggiore dispersione nei frutti affetti rispetto all’intervallo più ristretto osservato nel controllo.
Nel loro insieme, questi risultati sono coerenti con la riduzione dell’intensità del colore rosso evidenziata dalla colorimetria e con la deplezione di antociani precedentemente documentata nell’analisi chimica della buccia.
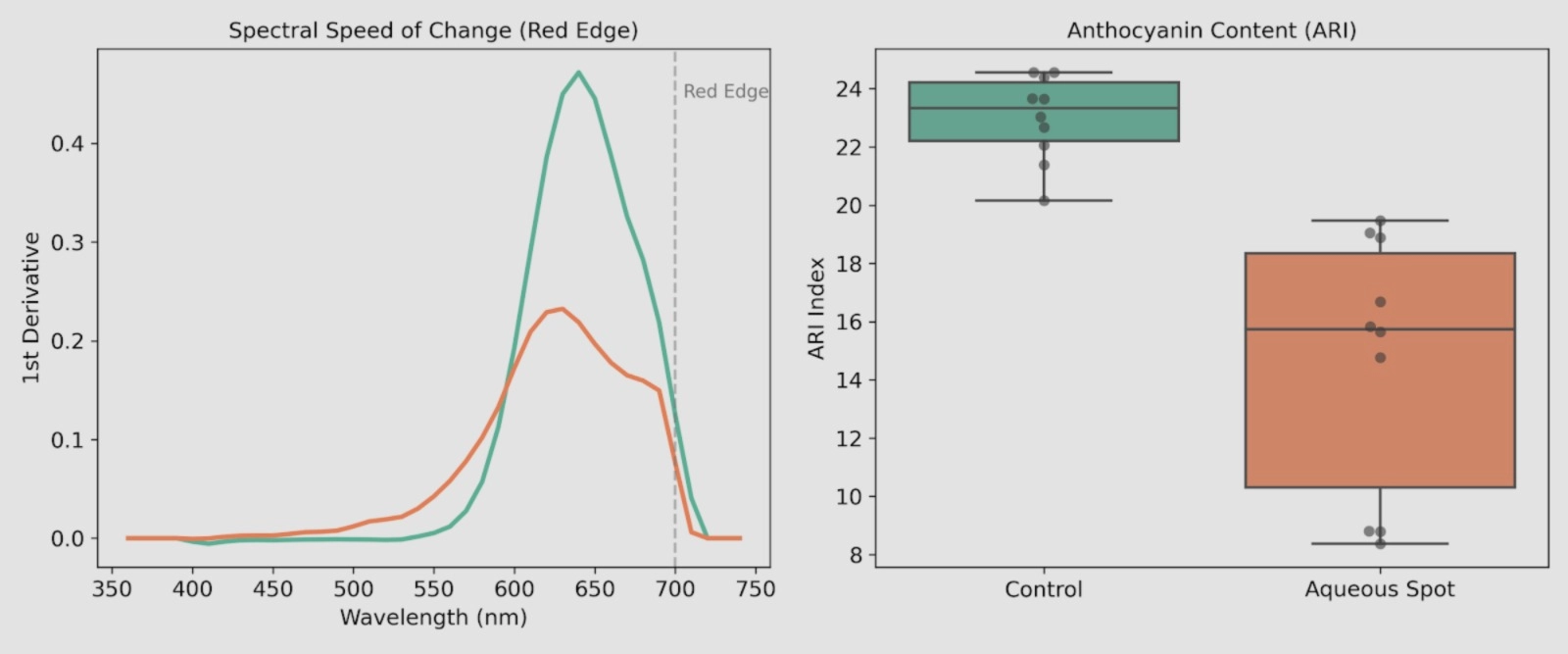 Figura 8. Sinistra: prima derivata della riflettanza nella regione del red-edge nella ciliegia dolce ‘Burlat’ (Controllo vs macchia acquosa). Destra: valori di ARI calcolati per ciascun frutto individuale in entrambi i gruppi. Le misurazioni sono state effettuate con uno spettrofotometro CM-3500d (Konica Minolta), illuminante D65 e osservatore a 10°.
Figura 8. Sinistra: prima derivata della riflettanza nella regione del red-edge nella ciliegia dolce ‘Burlat’ (Controllo vs macchia acquosa). Destra: valori di ARI calcolati per ciascun frutto individuale in entrambi i gruppi. Le misurazioni sono state effettuate con uno spettrofotometro CM-3500d (Konica Minolta), illuminante D65 e osservatore a 10°.
Per valutare se il segnale nel range del visibile contenga informazioni sufficienti a discriminare i frutti di controllo da quelli affetti da macchia acquosa, è stata applicata un’analisi delle componenti principali (PCA) all’intero set di spettri (n = 20).
Le prime due componenti catturano la maggior parte della varianza del sistema e il grafico dei punteggi PC1–PC2 mostra una separazione coerente tra i due gruppi (Fig. 9).
I frutti di controllo si raggruppano in una regione relativamente compatta dello spazio multivariato, mentre i frutti affetti risultano sistematicamente spostati rispetto a tale dominio, riflettendo un pattern spettrale distinto.
Questi risultati indicano che la macchia acquosa è associata a un’impronta ottica rilevabile mediante spettrometria nel visibile in condizioni controllate.
Considerata la natura esplorativa della prova e la dimensione del campione, la rilevanza operativa di questa separazione richiede ulteriori validazioni in condizioni che includano la variabilità tra campagne, lo stadio di maturazione, la severità delle lesioni e la geometria di misura.
Ciononostante, il pattern osservato è coerente con l’impiego di strumenti ottici—colorimetria strumentale, spettrofotometria o, in una fase successiva, imaging iperspettrale—come approccio non distruttivo per la discriminazione oggettiva di questa fisiopatia.
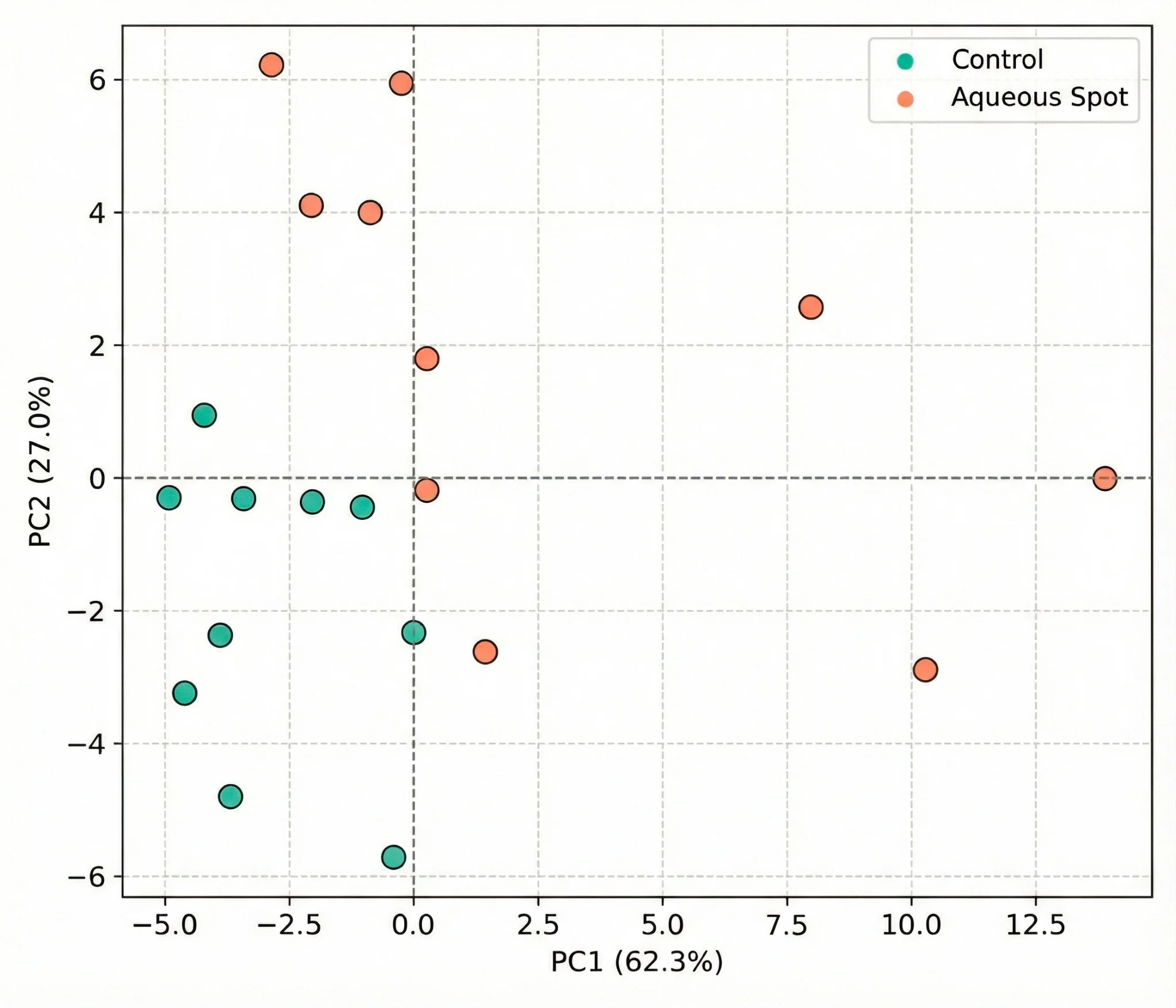 Figura 9. Grafico dei punteggi PCA ottenuto dagli spettri di riflettanza nel visibile (360–740 nm) nella ciliegia dolce ‘Burlat’, a confronto tra frutti di controllo e frutti affetti da macchia acquosa nel piano PC1–PC2. Le misurazioni sono state effettuate con uno spettrofotometro CM-3500d (Konica Minolta), illuminante D65 e osservatore a 10°.
Figura 9. Grafico dei punteggi PCA ottenuto dagli spettri di riflettanza nel visibile (360–740 nm) nella ciliegia dolce ‘Burlat’, a confronto tra frutti di controllo e frutti affetti da macchia acquosa nel piano PC1–PC2. Le misurazioni sono state effettuate con uno spettrofotometro CM-3500d (Konica Minolta), illuminante D65 e osservatore a 10°.
Le misure ottenute con il CM-3500d indicano che la macchia acquosa in ‘Burlat’ è associata a un segnale ottico coerente nel range del visibile (360–740 nm), sufficiente a discriminare frutti di controllo e frutti affetti mediante analisi multivariata.
Per verificare se questo pattern venga mantenuto al variare della strumentazione e con l’ampliamento della finestra spettrale, sono state condotte due prove aggiuntive utilizzando spettrometri portatili a fibra ottica: una estesa all’intero visibile (190–900 nm) e una seconda nel vicino infrarosso a onde corte (900–1700 nm).
In entrambi i casi, le misurazioni puntuali sono state effettuate sulla superficie del frutto impiegando geometrie e strumenti diversi da quelli utilizzati nella fase iniziale di colorimetria/spettrofotometria.
Lo spettrometro BLACK-Comet è stato utilizzato per acquisire spettri nel range 190–900 nm su un set indipendente di frutti (controllo e macchia acquosa).
Dopo il pretrattamento mediante correzione con standard normal variate (SNV) e trasformazione alla prima derivata, gli spettri medi mostrano differenze sistematiche tra i gruppi, con un contrasto particolarmente marcato nella regione del rosso, mentre le componenti di fondo risultano attenuate dallo stesso pretrattamento (Fig. 10, sinistra).
L’analisi delle componenti principali (PCA) riassume in modo coerente tali differenze: il grafico dei punteggi PC1–PC2 evidenzia due insiemi distinti, con ellissi di confidenza al 95% che mostrano solo una limitata sovrapposizione (Fig. 10, destra).
Ciò indica che il pattern ottico associato alla macchia acquosa viene preservato anche al cambiare della strumentazione e con l’estensione dell’intervallo spettrale verso l’ultravioletto e il far-red.
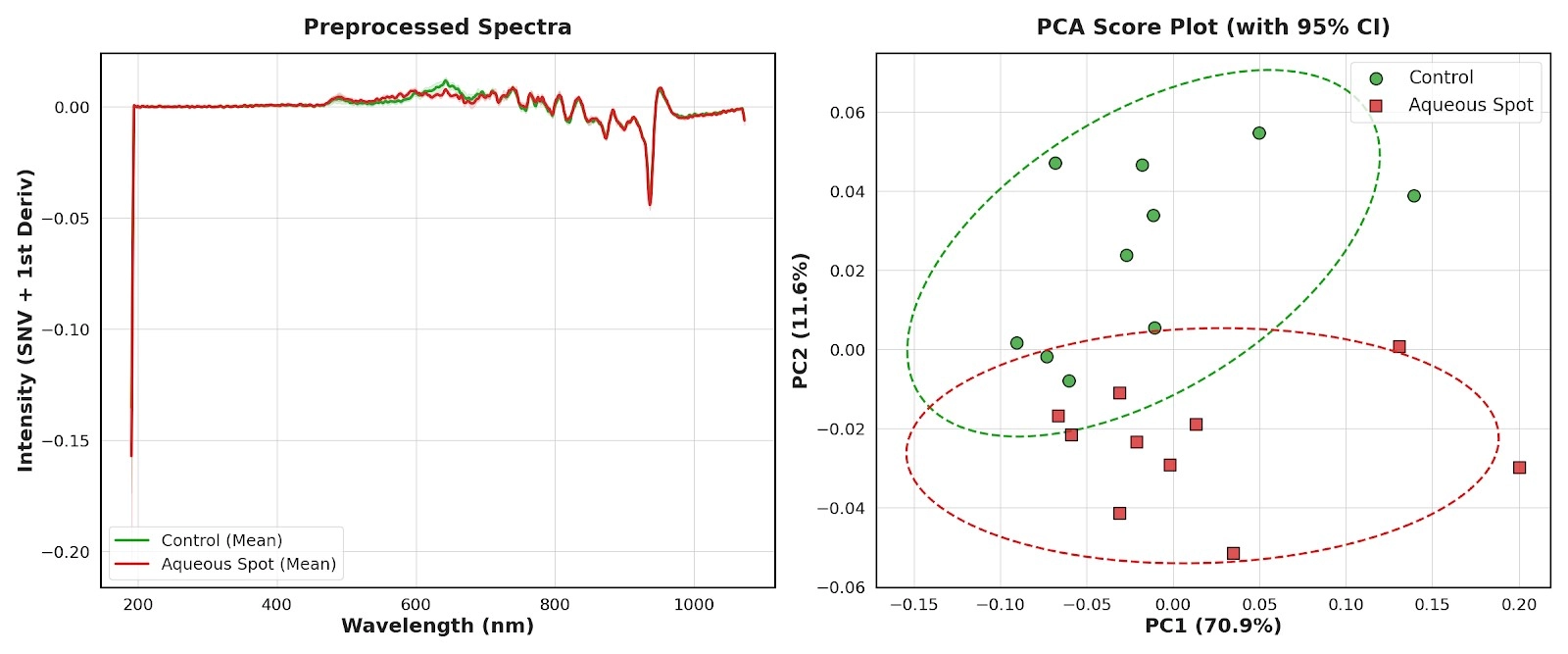 Figura 10. Sinistra: spettri medi pretrattati (SNV + prima derivata) acquisiti con lo spettrometro BLACK-Comet (190–900 nm) in ‘Burlat’, a confronto tra frutti di controllo e frutti affetti da macchia acquosa. Destra: grafico dei punteggi PCA per gli stessi spettri, con ellissi di confidenza al 95% (n = 10).
Figura 10. Sinistra: spettri medi pretrattati (SNV + prima derivata) acquisiti con lo spettrometro BLACK-Comet (190–900 nm) in ‘Burlat’, a confronto tra frutti di controllo e frutti affetti da macchia acquosa. Destra: grafico dei punteggi PCA per gli stessi spettri, con ellissi di confidenza al 95% (n = 10).
Su queste basi, è stato adattato un modello supervisionato PLS-DA per classificare i frutti di controllo rispetto a quelli affetti da macchia acquosa.
Utilizzando solo due variabili latenti, la cross-validazione leave-one-out ha restituito un’accuratezza di classificazione del 100%, senza alcuna errata assegnazione tra le classi (Fig. 11, sinistra).
Nel contesto di questo dataset e della geometria di misura adottata, il risultato indica che il pattern spettrale associato al disordine contiene informazioni discriminanti sufficienti per una classificazione robusta nell’intervallo 190–900 nm.
L’analisi dei coefficienti di regressione del modello PLS-DA consente inoltre di identificare le regioni spettrali che contribuiscono maggiormente alla discriminazione.
Il contributo assoluto più elevato si osserva attorno a 638,5 nm (Fig. 11, destra), all’interno della regione del rosso dello spettro.
Dal punto di vista fisiologico, questo intervallo è strettamente associato all’assorbimento da parte dei pigmenti epidermici, in particolare antociani e altri composti fenolici colorati.
Il contributo dominante di questa banda è coerente con la perdita di pigmentazione evidenziata dalla colorimetria e con la deplezione di antociani quantificata nell’analisi chimica, e suggerisce che la regione del rosso concentri una parte sostanziale del segnale ottico associato alla macchia acquosa.
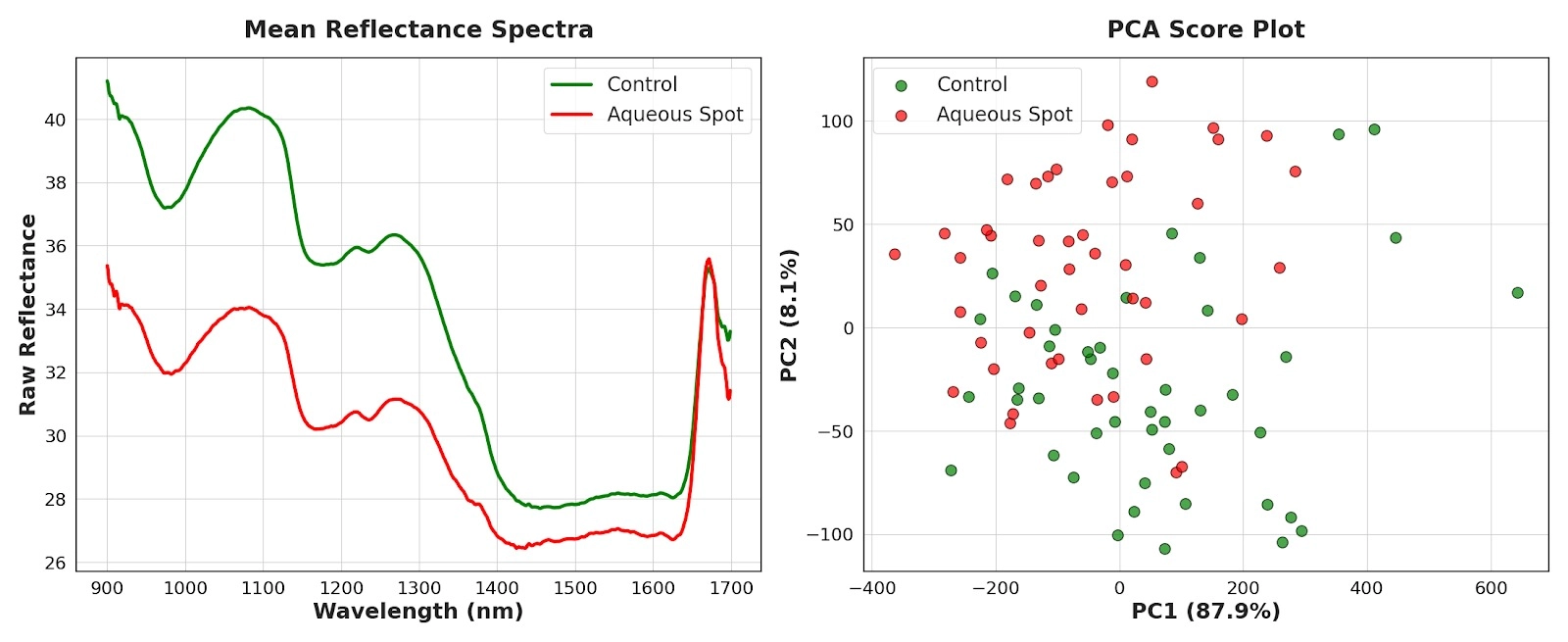 Figura 11. Sinistra: matrice di confusione del modello PLS-DA basato su spettri nel visibile a banda larga (190–900 nm) in cross-validazione leave-one-out. Destra: coefficienti di regressione del modello PLS-DA in funzione della lunghezza d’onda, con evidenziazione della regione di massimo contributo attorno a 638,5 nm.
Figura 11. Sinistra: matrice di confusione del modello PLS-DA basato su spettri nel visibile a banda larga (190–900 nm) in cross-validazione leave-one-out. Destra: coefficienti di regressione del modello PLS-DA in funzione della lunghezza d’onda, con evidenziazione della regione di massimo contributo attorno a 638,5 nm.
La terza prova è stata condotta nel vicino infrarosso a onde corte (short-wave NIR) utilizzando uno spettrometro portatile DWARF-Star, con l’obiettivo di valutare se la macchia acquosa in ‘Burlat’ sia accompagnata da una firma ottica compatibile con variazioni dello stato idrico dei tessuti e/o delle loro proprietà ottiche interne.
In questo caso è stato analizzato un campione ampliato (n = 45) e sono stati utilizzati spettri di riflettanza grezzi, al fine di preservare le informazioni di ampiezza potenzialmente legate al fenotipo di impregnazione d’acqua.
Le curve medie di riflettanza hanno mostrato un pattern stabile: lungo la maggior parte dell’intervallo 900–1700 nm, i frutti affetti da macchia acquosa presentano valori di riflettanza inferiori rispetto al gruppo di controllo (Fig. 12, sinistra).
Questa diminuzione sistematica è coerente con un aumento dell’assorbimento effettivo e/o con modificazioni concomitanti della diffusione interna, due componenti che nel NIR sono fortemente modulate dal contenuto d’acqua e dall’organizzazione microstrutturale del tessuto.
L’analisi delle componenti principali (PCA) ha sintetizzato chiaramente tale differenza: la prima componente cattura la maggior parte della varianza e il grafico dei punteggi riflette un gradiente dominato dall’ampiezza spettrale, con una netta separazione tra frutti di controllo e frutti affetti (Fig. 12, destra).
Nel complesso, il NIR intercetta un segnale globale coerente con uno stato fisico alterato del tessuto nelle aree colpite.
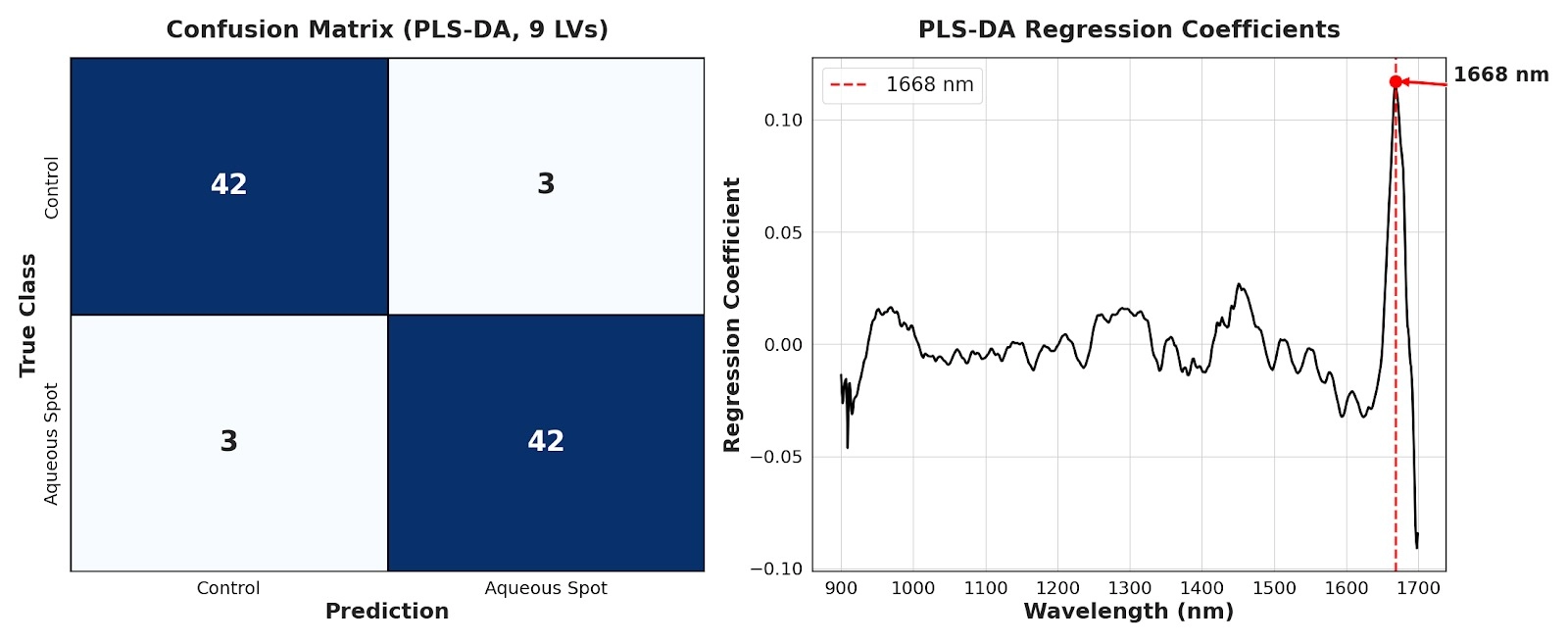 Figura 12. Sinistra: spettri medi di riflettanza grezzi nel NIR (900–1700 nm) per ciliegie dolci ‘Burlat’ di controllo e affette da macchia acquosa (DWARF-Star). Destra: grafico dei punteggi PCA corrispondente (PC1–PC2).
Figura 12. Sinistra: spettri medi di riflettanza grezzi nel NIR (900–1700 nm) per ciliegie dolci ‘Burlat’ di controllo e affette da macchia acquosa (DWARF-Star). Destra: grafico dei punteggi PCA corrispondente (PC1–PC2).
Sulla base di questi dati, è stato costruito e ottimizzato mediante cross-validazione un modello PLS-DA, che ha mostrato elevate prestazioni di classificazione con un numero limitato di errori e senza evidenti bias verso una delle due classi (Fig. 13, sinistra).
Le residue errate classificazioni risultano compatibili con l’eterogeneità attesa nell’espressione e nella severità delle lesioni, nonché con una parziale sovrapposizione tra le condizioni.
L’analisi dei coefficienti di regressione del modello PLS-DA ha individuato un contributo dominante attorno a 1668 nm (Fig. 13, destra).
Questa regione del NIR è comunemente sensibile a bande di combinazione e di sovratono che coinvolgono i legami O–H; di conseguenza, la sua rilevanza è coerente con una componente legata allo stato e alla distribuzione dell’acqua nel mesocarpo esterno, in accordo con il fenotipo di impregnazione d’acqua e con il collasso tissutale descritti in precedenza.
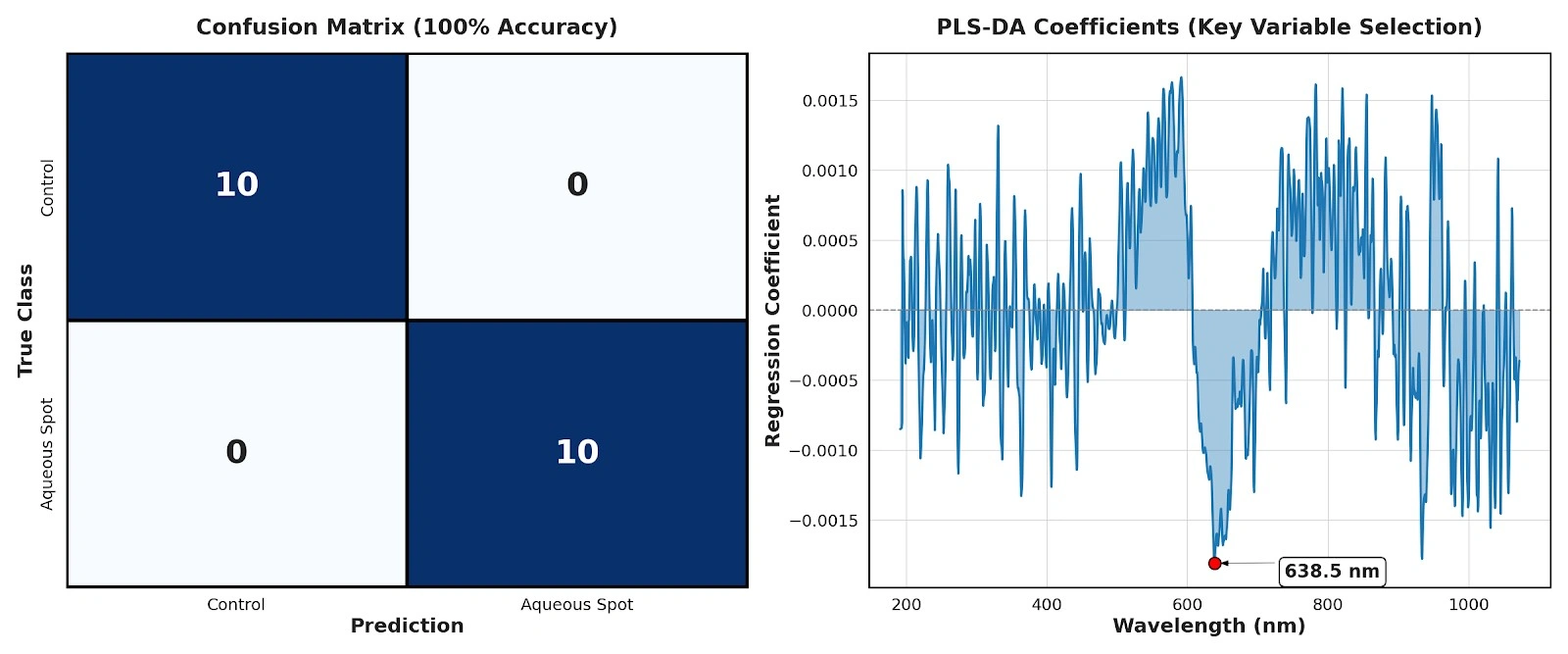 Figura 13. Sinistra: matrice di confusione del modello PLS-DA basato su spettri NIR (900–1700 nm) per il confronto tra frutti di controllo e frutti affetti da macchia acquosa. Destra: coefficienti di regressione del modello PLS-DA, con evidenziazione della regione di massimo contributo attorno a 1668 nm.
Figura 13. Sinistra: matrice di confusione del modello PLS-DA basato su spettri NIR (900–1700 nm) per il confronto tra frutti di controllo e frutti affetti da macchia acquosa. Destra: coefficienti di regressione del modello PLS-DA, con evidenziazione della regione di massimo contributo attorno a 1668 nm.
Nel loro insieme, i tre livelli analitici—colorimetria CIE LCh°, spettroscopia nel visibile e spettroscopia a banda larga nel visibile/NIR—convergono verso un quadro interpretativo coerente della macchia acquosa in ‘Burlat’.
Nell’area colpita si osservano: (i) uno spostamento nello spazio colore verso una riduzione dell’intensità del rosso, caratterizzato da un aumento della luminosità, una diminuzione della croma e una variazione della tonalità; (ii) una modificazione del profilo spettrale nel visibile, con attenuazione del gradiente del red-edge e cambiamenti nella regione verde–gialla, coerenti con una ridotta contribuzione effettiva degli antociani; e (iii) una diminuzione sistematica della riflettanza grezza nel NIR a onde corte, compatibile con uno stato idrico alterato dei tessuti e con modificazioni delle proprietà ottiche interne nella zona lesionata.
Dal punto di vista della discriminazione non distruttiva, questa convergenza risulta rilevante per due motivi.
In primo luogo, la prova nel visibile a banda larga indica che una quota sostanziale dell’informazione discriminante è concentrata nella regione del rosso, attorno a ~640 nm, il che—nel contesto sperimentale considerato—supporta la fattibilità di approcci multispettrali basati su un numero limitato di bande.
In secondo luogo, il NIR fornisce un segnale aggiuntivo, in larga misura associato a regioni sensibili ai legami O–H, che può essere considerato complementare al visibile, in quanto intercetta variazioni legate allo stato idrico dei tessuti e alla loro organizzazione microstrutturale.
Ciononostante, la portata di questi risultati deve essere considerata preliminare.
La definizione della stabilità dell’impronta ottica richiederà ulteriori validazioni su più stagioni e, soprattutto, su altre cultivar e su un più ampio spettro di condizioni colturali, stadi di maturazione e geometrie di misura, prima di ipotizzarne una traduzione diretta in contesti operativi di classificazione o selezione.
Nella ciliegia dolce ‘Burlat’, l’insieme delle evidenze integrate generate in questo studio supporta l’interpretazione della macchia acquosa come una fisiopatia epidermico–subepidermica, caratterizzata da una tipica espressione macroscopica e da un substrato tissutale chiaramente identificabile nel mesocarpo esterno.
Le osservazioni strutturali e microstrutturali indicano che il fenomeno non è riconducibile a una semplice alterazione cromatica superficiale, ma coinvolge modificazioni dei tessuti periferici coerenti con una perdita di integrità e con un collasso localizzato, fornendo un quadro fisiopatologico congruente con la progressione visibile della lesione.
In parallelo, la caratterizzazione compositiva e qualitativa mostra che l’area colpita presenta una marcata alterazione del profilo fenolico, in particolare dei composti alla base della pigmentazione rossa, e che tale cambiamento è accompagnato da variazioni misurabili nella risposta fisico-meccanica del frutto, con la consistenza che emerge come la variabile più sensibile tra i parametri qualitativi valutati.
A livello fisiologico, la risposta legata all’etilene fornisce un segnale complementare coerente con uno stato tissutale alterato, senza implicare necessariamente una variazione parallela dei classici indici di maturazione interna al momento del campionamento.
Dal punto di vista della diagnostica non distruttiva, il risultato più rilevante è che la macchia acquosa è associata a una firma ottica coerente sia nel visibile sia nel NIR a onde corte.
Nel dominio del visibile, la combinazione di variazioni colorimetriche e spettrali—including l’attenuazione della transizione del red-edge e il comportamento degli indici correlati agli antociani—dimostra che la lesione modifica in modo sistematico l’interazione tra radiazione e tessuto, con un contributo discriminante particolarmente marcato nella regione del rosso (~640 nm).
Nel NIR (900–1700 nm), la diminuzione complessiva della riflettanza grezza e la rilevanza di regioni sensibili ai legami O–H (attorno a ~1668 nm) risultano coerenti con variazioni dell’assorbimento e della diffusione interna modulate dall’acqua e dalla microstruttura, rafforzando l’interpretazione di un fenotipo di tipo water-soaking nell’area colpita.
Nel complesso, questo lavoro delinea un quadro coerente per l’interpretazione della macchia acquosa in ‘Burlat’ e dimostra che la sua espressione fisiopatologica lascia un segnale ottico quantificabile che può essere sfruttato, in condizioni controllate, per una discriminazione oggettiva tra tessuto sano e tessuto colpito.
Il passo successivo imprescindibile, prima di qualsiasi estrapolazione operativa, consiste nel verificare la stabilità di questa impronta su più stagioni, genotipi e geometrie di misura più rappresentative dei contesti applicativi; su tali basi, successive analisi iperspettrali consentiranno di valutare non solo le prestazioni di rilevamento, ma anche il potenziale di stratificazione della severità e la generalizzabilità dell’approccio.
Jesús Alonso 1,2,3
Óscar G. Bodelón 2
1 University Institute for Research on Agricultural Resources (INURA), University of Extremadura, Avda. de la Investigación s/n, Campus Universitario, 06006 Badajoz, Spain
2 Institute of Food Science, Technology and Nutrition, Spanish National Research Council (ICTAN-CSIC), C/ José Antonio Novais, 10, 28040 Madrid, Spain
3. Cherry Times technical-scientific committee